
批准的药物是研究生化途径的宝贵工具,这些化合物的进一步表征可能会导致单一药物或组合药物的用途改变。在这里,我们描述了308个小分子的集合,这些小分子代表了所有FDA批准的化学实体的结构和分子靶标的多样性。 CeMM独特药物资料库(CLOUD)涵盖药理学相关浓度的前药和活性形式,非常适合组合研究。我们筛选了成对组合的CLOUD药物,以降低癌细胞的生存能力,并发现氟他胺和苯普洛蒙(PPC)之间存在协同作用。这些药物的组合可调节雄激素受体(AR)的稳定性,并使AR突变型前列腺癌细胞对氟他胺重新敏感。从机制上讲,我们显示AR是g-羧化的底物,这是PPC抑制的翻译后修饰。总体而言,我们的数据表明,PPC可以重新用于应对前列腺癌患者对抗雄激素的耐药性。
Pipeline Pilot Chemistry 模块可以使您非常方便对包含化合物的信息进行处理和分析,包括建立化合物数据库、子结构匹配和检索、化学反应的分析处理等。并且,通过和其他软件联用,可以方便地进行材料结构和生物分子的模拟工作。
ref:Nat Chem Biol. 2017 Jul;13(7):771-778 IF=13.843
链接:https://www.nature.com/articles/nchembio.2382
药物发现是一个挑战性的过程,通常需要10到15年的时间。尽管最近有技术进步,但每年批准的新分子实体的数量仍低于预期。工业界和学术界的研究人员都试图通过将临床化合物重新定位以用于新的治疗适应症来绕开药物发现的障碍,这一过程通常称为药物重新利用。
患者的多样性和耐药性是对癌症和感染等疾病进行长期药理治疗的主要障碍。在这些情况下,多成分疗法可能是有效的替代方法,为个性化医疗提供了新的策略。已批准的安全,有效和可生物利用的药物,具有明确的靶标和作用机制,是开发新的多组分方案的理想起点,并为新的临床应用提供了快速通道。这些独特的功能促使人们对所有批准用于人类或兽用途的药物进行分类和收集;但是,对这些综合库的访问受到限制。此外,目前美国国立卫生研究院化学基因组学中心(NCGC)药物收集中的所有14,814个分子的系统成对组合高通量筛选(HTS)将产生超过1亿个数据点,这超出了现有筛选设施的能力。
在本研究中,以计算方式导出一组已获得美国食品和药物管理局(FDA)批准的代表性药物。目标是生成一个化合物的集合,该集合可以最佳地捕获所有临床化合物的生化多样性,同时可安装在单个384孔筛选板上。用已报告的人血浆峰值浓度对该集合进行了注释,以鼓励以药理学相关剂量的HTS。将此临床化合物的集合命名为CeMM独特药物图书馆(CLOUD)。创建CLOUD过程中,使用Pipeline Pilot对具有已知靶标的920 STEAM药物进行结构聚类。将结构表示为扩展连接指纹(ECFP),并将Tanimoto系数用作结构距离的度量。对于簇形成,将Tanimoto差异设为0.85。如果该阈值不能涵盖药物类别内的大多数治疗活动,则可以通过逐步操作降低该阈值。该脚本用于识别176种药物类别中每个类别的聚类中心。保留了所有聚类中心,提供了最终的239种结构独特的CLOUD药物。在这些药物中,添加了34种目标未知的STEAM药物和35种前药的活性形式。化合物主要从Enamine Ltd,Toronto Research Chemical和Sigma-Aldrich购买。同时,也基于Pipeline Pilot软件根据分子的化学结构计算了分子量,logP,可旋转键的数目,氢键受体或供体的数量以及违反Lipinski规则的相应理化性质。
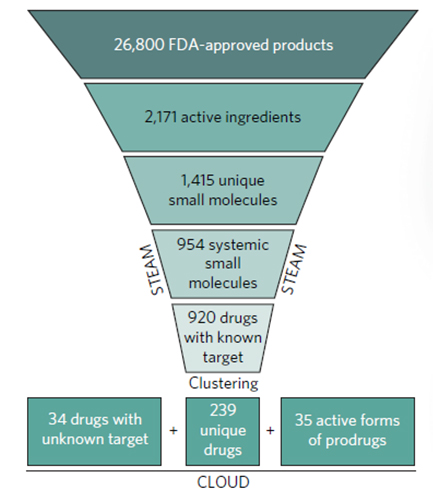
图一. CLOUD药物分子产生过程
库的非冗余性质允许对CLOUD化合物的所有组合进行系统研究。在评估癌细胞生存力的组合式HTS中,发现了氟他胺和PPC,CLOUD中代表抗雄激素和维生素K拮抗剂的批准药物之间存在协同作用。发现这两种药物之间的协同作用在多种前列腺癌细胞系中得以保留。氟他胺和PPC的同时给药会损害带有AR突变的前列腺细胞的活力,这些突变与患者对治疗的抵抗力有关。研究结果表明,维生素K拮抗剂可在临床中用于解决AR突变介导的抗雄激素耐药性。