
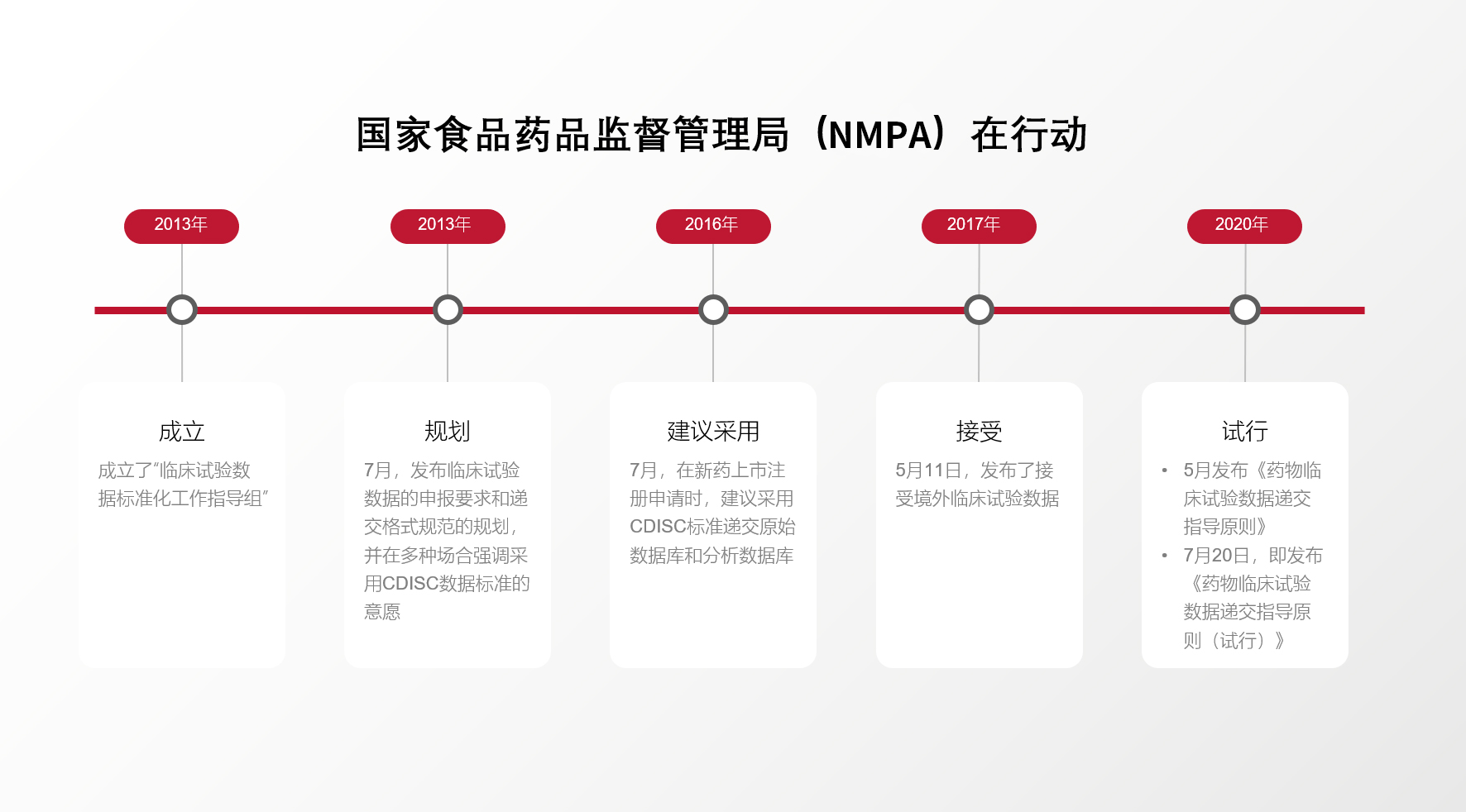
讲座主题:Pinnacle 21 Enterprise助力企业向监管机构递交高质量、标准化的试验数
讲座时间:2023年7月18日(周二),14:00
主 讲 人:创腾科技讲师
报名方式:扫描下方二维码 或 点击链接

进入直播间,打开后记得收藏
试验数据是申办方向监管机构递交的重要资料之一,对于监管机构和申办方来说都是宝贵的资源。规范地收集、整理、分析和呈现试验数据对于提高药物研发的效率和质量、缩短审评时间具有重要的作用,并且有利于药品全生命周期管理,促进研发或监管的信息互通或共享。
为了确保试验结果的准确可靠、科学可信,国际社会和世界各国都纷纷出台了一系列非临床与临床试验数据递交的法规和指导原则,也促进了医药行业数据标准化的发展。
在试验数据分析和报告阶段您是否有以下问题?
01 试验数据是否符合每个监管机构对数据合规性和适用性的要求
递交美国食品药品监督管理局(FDA)、日本医药品与医疗器械局(PMDA)或中国国家药品监督管理局 (NMPA)的数据如果存在问题或质量不高,可能会被监管拒绝、补充材料或使审评工具产出的结果发生偏离,无法支持审评人员科学、客观的给出评价。
02 应该如何应对和解决不断发现的数据质量问题
查验自定义标准、术语和业务规则是否符合CDISC,哪些是需要改进的。
03 如何高效地制作符合申报要求的Define.xml与SDRG数据审阅说明文件
这次研讨会,我们将分享P21 Enterprise 如何协助解决这些问题,提高数据流转的准确性、一致性、可朔源性,避免重复的工作和重复决策。
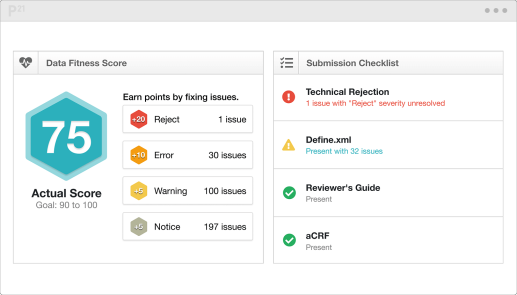
图 | 试验数据评分页
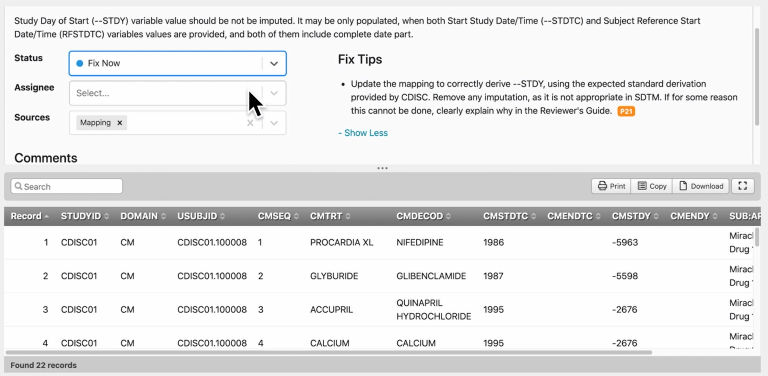
图 | 问题管理页面
Pinnacle 21 Enterprise 是在利用高质量数据支持知情决策领域的全球领导者,包括为向监管机构申报递交准备非临床研究与临床试验数据。Pinnacle 21 Enterprise 使我们的客户能够验证数据质量、符合 CDISC 标准、实现从数据管理团队到生物统计团队到卫生当局的顺畅的数据管道。全球最大的 25 家生物制药公司中,有 24 家信任 Pinnacle 21 Enterprise来改善其数据质量。美国 FDA 和日本 PMDA 使用同一个平台用于评估和审评申报资料的数据质量、CDISC 合规性与数据适用性。
您也可以根据监管机构的拒绝标准来判断数据集的情况,提前修正问题、降低风险,从而加快审评过程。
◆ 使用仪表板和评分算法来监测申报数据准备的进度。
◆ 使用清晰的前视图和后视图来跟踪多次验证运行之间的变更。
◆ 使用我们预先构建的报告更深入地挖掘分析您的数据构成,从而展现模式和不一致之处。