
近日,NMPA发布《药品记录与数据管理规范(征求意见稿)》,不久将发布正式版,并全面推行。该份征求意见稿中,使用大量篇幅提及了对“电子记录”的相关要求,创腾科技医药顾问团队就该征求意见稿给出了专业解读及相应解决方案。
《药品记录与数据管理规范(征求意见稿)》原文请访问:
http://www.nmpa.gov.cn/WS04/CL2101/375172.html
既强调“结果”又关注“过程”
该征求意见稿中,首次将记录与数据作区分,明确了“记录与数据的定义与关系”,即“数据” 是“指在药品研制、生产、经营和使用活动中产生的反映活动执行情况的信息”,强调结果;“记录”是“在上述活动中通过一个或多个数据记载所形成的,反映相关活动执行过程与结果的凭证”,关注过程。既强调结果,又关注过程,充分体现出新规范对药品数据管理的要求将大幅提高。
药品数据管理的“电子记录时代”来临
首先,面对如此复杂严密的记录与数据管理要求,无论是对企业,还是监管人员来说,都将面临一次不小的挑战。药企试图单纯沿用纸质+人工的管理方式,是很难做到合规要求的,而持续合规更是难上加难。而监管人员在实际执行时,也将面临众多难题,例如纸质记录中,由于可能存在无法真实记录数据的实际产生时间,将很难核查记录的“真实性”、“及时性”。因此,这也就不难理解,在该征求意见稿中,“电子记录”的相关表述会占据全文约70%的篇幅,充分体现了“电子记录”在真正落实规范要求过程中的重要地位!
其次,该征求意见稿中明确了电子记录和电子签名的适用范围:包括药品研制、生产、经营和使用活动的全部环节,这必将是电子记录能够真正实现广泛推行的十分有利的前提条件!
综上,足以看出,为确保法规的顺利执行以及整个医药行业良性有序的发展,NMPA在药品质量管理和药品数据管理方面推行电子记录的决心之足、力度之大!药品数据管理的“电子记录时代”已经来临!
新规范下的电子记录解决方案
该征求意见稿中明确,新规范适用于药品研制、生产、经营和使用活动等全过程的记录与数据管理。而实际上,药品研发环节(与药品申报相关)与药品检测/生产环节(GLP/GMP环境下),由于实际执行过程差异巨大,因此对电子记录系统功能的要求其实有很大不同。
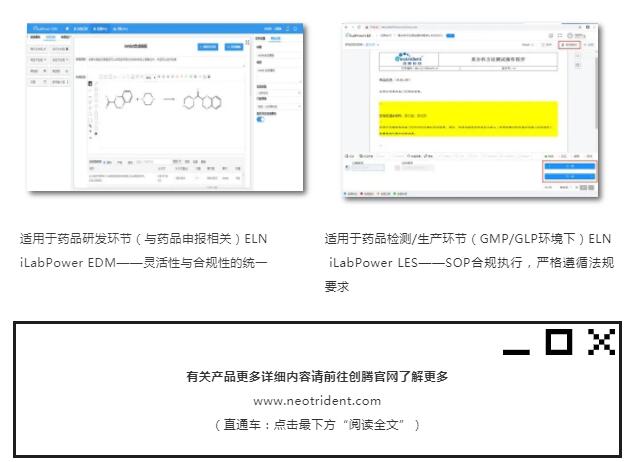
接下来,创腾科技医药顾问团队将结合本征求意见稿,详细解析上述两款ELN与新规范的契合度!
(1)确保数据获取的原始性、及时性、真实性与一致性
支持移动应用,通过借助手机APP实时获取第一手数据,例如通过语音(转文字)记录操作步骤,实时拍照上传,添加时间戳,自动获取仪器数据等,能够清除实验记录无纸化过程中的最后一道障碍。
(2)记录清晰、可查
具备丰富的检索功能,能够快速定位目标内容。
(3)审计追踪,安全合规
保留系统操作日志;实验记录的每次版本更新与修改痕迹均自动保留,并自动生成审计追踪报告,从而实现“真实、准确、完整和可追溯”。
(4)严格的权限密码管理
具备严格的用户权限设置与分配功能,能够对权限修改进行跟踪与查询,不同角色用户权限可根据其职责范围进行分配,与此同时,通过合规的账号密码管理策略,严格控制数据访问及操作,以确保数据的安全性及有效性。
(5)电子签名
电子签名,完全符合FDA 21 CFR Part 11和《中华人民共和国电子签名法》的规定,实现对数据修改、审批等关键操作的控制,确保数据的归属性及不可抵赖性。
(6)数据复核
能够满足数据复核操作的执行,实现人工复核及电子复核,确保数据录入的准确性和处理正确性。
(7)满足系统验证要求
依照ISPE GAMP5的要求,iLabPower EDM,iLabPower LES隶属4类可配置性系统,具有完善的产品质量验证体系。创腾科技实施团队,严格按照四类验证V模型,已经成功为包括科伦药业在内的国内多家企业提供了计算机(化)系统验证服务,帮助企业顺利通过FDA/EMA等多个监管部门的核查。
创腾科技专注于实验室信息化建设20年,以系统合规为前提,融合先进IT技术赋能组织的研发创新、保障产品质量合规。创腾科技ilabPower研发创新平台,以加速研发创新为源动力,目前已成功应用于超过50家研发创新企业和研究机构,包括:国内顶尖的药物研发企业和石化研究院、国内知名医药CRO、多家国内顶尖研究机构与学术单位。创腾科技合规性质量分析平台,以恪守产品质量合规为目标,目前已成功应用于多家国内药企的质量部门,包括:国内大输液医药龙头企业等,助力药企保障产品质量,并通过相关监查机构的核查。