

解决方案人表皮生长因子受体2(HER2)是酪氨酸激酶的跨膜受体,是表皮生长因子受体(EGFR)家族的一员,具有酪氨酸激酶活性,在组织发育中起至关重要的作用,是胚胎发育所必需的。在正常成年人机体组织中,HER2通常低表达或不表达。但是,HER2的过表达往往会引起正常生物学功能的紊乱。许多研究表明,HER2的表达与多种肿瘤的发生、发展密切相关,如乳腺癌、胃癌、结肠癌、膀胱癌、卵巢癌、子宫内膜癌、肺癌等。因此以HER2为靶点的肿瘤靶向治疗一直是研究的热点。
2022年7月一篇发表在Researchgate网站上的名为“Designing a Humanized Immunotoxin Based on HER2 Specific scFv and DFF40 Toxin Against Breast Cancer: An In-Silico Study”的文章,提出以分子模拟技术来进行基于HER2特异性scFv和DFF40毒素设计抗乳腺癌人源化免疫毒素的研究。
曲妥珠单抗是一种能与HER2受体结合的抗体,其衍生的单链抗体(scFv)可用于设计靶向HER2阳性癌细胞的免疫毒素。DFF40是一种由半胱氨酸天冬氨酸蛋白酶-3激活的核酸酶,负责细胞凋亡过程中的基因组DNA片段化。在该研究中,研究人员利用生物信息学工具设计了含有HER2特异性scFv和DFF40毒素的免疫毒素。将scFv和DFF40的氨基酸序列通过肽链连接,构建免疫毒素。然后对该结构的二级结构、理化特性、溶解度和致敏性进行了预测,并进行三维结构的建立、改进和评估,最后分别进行蛋白-蛋白对接和分子动力学研究,评价免疫毒素与受体的结合和免疫毒素的稳定性。结果表明,所设计的蛋白是一种溶解度适宜的稳定蛋白,不具有过敏原性质,具有与HER2结合的合适结构。最后,该构建体有望成为制备靶向HER2免疫毒素的候选材料。然而,需要进行不同的体外和体内免疫学试验来确认所设计的结构的效果。
实验方法
1
结构设计
将曲妥珠单抗(赫赛汀)单链抗体(scFv)与DFF40毒素偶联,构建融合蛋白曲妥珠单抗-DFF40。从UniProtKB (http://www.uniprot.org/)中获得融合蛋白的氨基酸序列。(G4S)3是一种柔性肽连接体,用于将赫赛汀的VL和VH与DFF40结合(图1)。
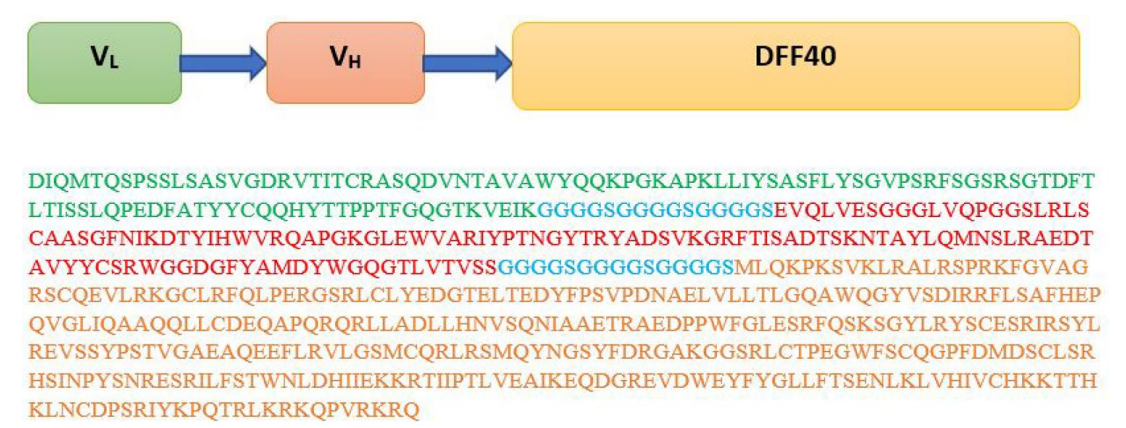
2
二级结构评价
首先根据一级氨基酸序列对曲妥珠单抗-DFF40融合蛋白的二级结构进行预测。首先分别分析VL和VH的二级结构,然后评估scFv及其连接子的结构。
3
物理化学性质和溶解性分析
蛋白质的物理化学性质对其稳定性和溶解度有实质性的影响。因此,作者首先计算研究了曲妥珠单抗-DFF40融合蛋白的理论等电点(pI)、分子量(MW)、总电荷、不稳定指数、脂肪指数和总平均亲水性等理化特性。使用AI预测结构的溶解度。
4
构建三维模型,改进和验证建模结构
首先通过建模构建曲妥珠单抗-DFF40融合蛋白的三维结构并进行优化,优化方法包括侧链重建和修复。最后评价三维结构的质量。
5
抗原性预测
通过基于非序列描述符的指纹识别方法评估该蛋白的过敏原性。
6
mRNA 稳定性预测
根据能量最小化预测设计的免疫毒素的单链RNA或DNA序列的二级结构。
7
蛋白-蛋白对接分析
利用蛋白蛋白对接软件预测从PDB数据库获得的HER2 (PDB ID: 5WJL)受体与设计的免疫毒素之间的受体-配体相互作用模式。
8
分子动力学模拟研究
通过MD模拟研究,选择相互作用最强的HER2免疫毒素模型评估其稳定性和结构变化。分子动力学的模拟使用GROMACS 2018包和OPLS-AA力场在一个10Å立方的模拟盒中进行,采用SPC作为水模型。然后,系统的电荷被Na+和Cl-离子中和。采用最陡下降法最小化对接模型的能量,通过5000步最小化,Fmax小于100 kJ/mol/nm。此外,对模拟系统进行了100ps NVT(粒子数、体积和温度恒定)和NPT(粒子数、压力和温度恒定)的平衡。使用线性约束求解器(LINCS)算法对所有约束进行组织。采用半径为1.0 nm、网格间距为0.16 nm的PME算法计算静电相互作用。最后,对于HER2 -免疫毒素复合物,在平衡系统上用两个fs时间步长进行了100 ns的模拟过程。评价HER2 -免疫毒素复合物的稳定性、计算溶剂可及表面积(SASA)、均方根偏差(RMSD)、氢键(H-bonds)、均方根波动(RMSF)和旋转半径(Rg)。
实验结果
1
融合蛋白的构建
从PDB和Uniprot数据库中检索曲妥珠单抗scFv和DFF40蛋白的氨基酸序列。选择GGGGSGGGGSGGGGS氨基酸序列作为VL和VH之间的连接物,用于形成赫赛汀。该柔性连接子也被选为连接抗体与毒素的最佳连接子。
2
二级结构预测
预测scFv和曲妥珠单抗 (scFv-DFF40蛋白)的二级结构。结果表明,在scFv中加入DFF40并形成嵌合蛋白,并不改变该片段的二级结构。二级结构由20.37%的α-螺旋、22.39%的延伸链和57.24%的无规卷曲构成。
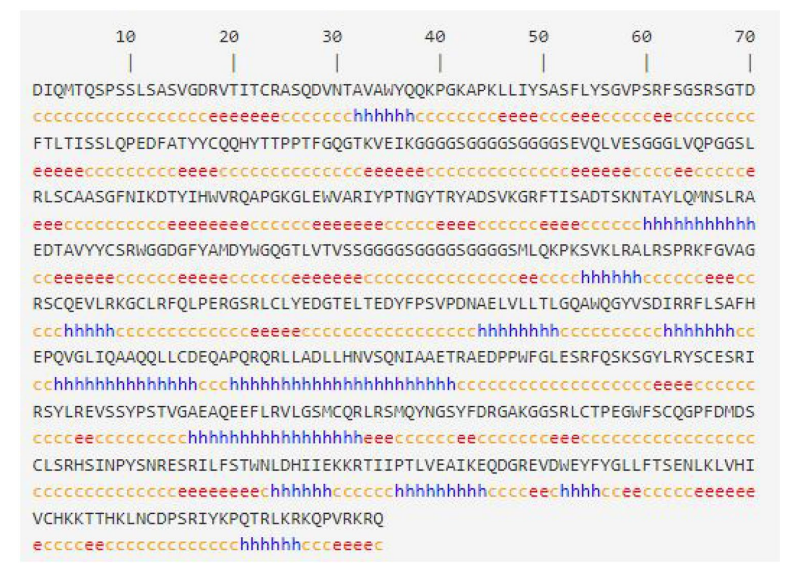
图2:设计的免疫毒素的二级结构。c:无规螺旋,e:延伸股,h: α螺旋
3
理化性质和溶解度评价
对嵌合蛋白序列进行理化性质分析。根据所得结果,分子量为65.95 kDa,理论pI为9.12,净电荷为+16。结果表明,嵌合蛋白是可溶的,概率评分为0.57。
4
建立三维模型,对模型进行修正和验证
在本研究中,基于氨基酸序列预测蛋白质的三维结构;为该免疫毒素创建了5个3D模型。根据三维建模模型计算的置信值(c-score),在5个模型中,选择c-score为0.32的模型1(图3)为置信值最高的模型。为了进一步完善预测模型,研究人员选择了Ramachandran图中最有利区域作为进一步研究的模型。研究人员对嵌合蛋白结构进行验证,并对所选模型改良前后的质量进行评价。未细化和细化模型在拉氏图中残基分布的比较见表1。改良后,最优区氨基酸比例由50.7%提高到66.9%。改进后的模型Z-score为-7.02,为可接受值(图4)。
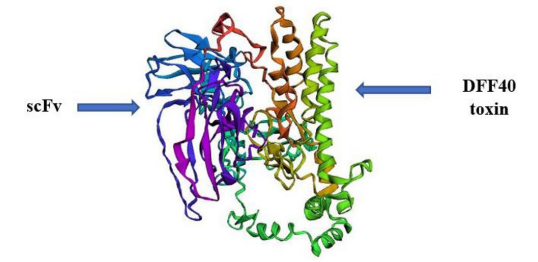
图3免疫毒素的三维结构。scFv: 1 ~ 256个氨基酸;DFF40: 257 – 594
表1:改良前后拉氏图中模型的氨基酸位置
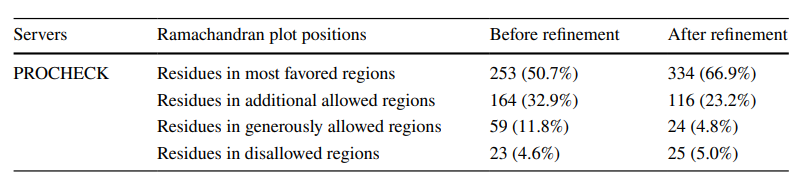
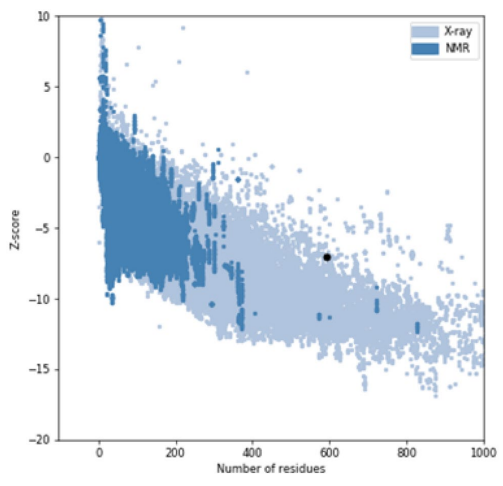
图4:改进模型的Z-score -7.02。z-评分显示了与实验定义结构相比的总体模型质量
5
过敏性评价
评估嵌合蛋白致敏潜能的结果,设计的嵌合蛋白是一种非致敏原。
6
mRNA稳定性评价
通过最小自由能(MEF)预测mRNA二级结构。结果显示,由于热力学集合的负自由能(−825.79 kcal/mol),该mRNA是稳定的。
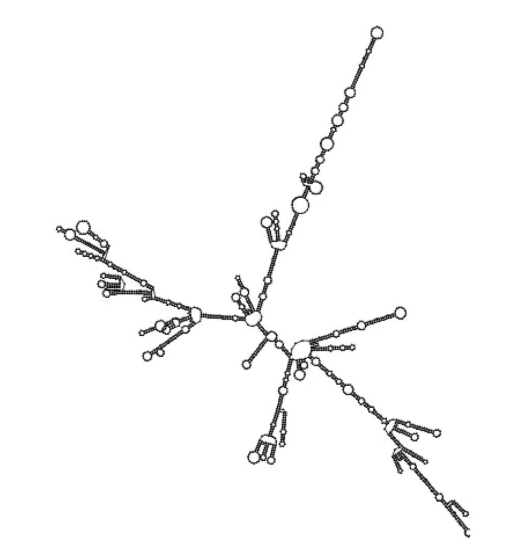
图5:预测的mRNA二级结构
7
蛋白-蛋白分子对接
利用蛋白蛋白对接软件进行免疫毒素与HER2受体的分子对接。根据 (Kd)评分最低(5.7E-16)、HER2受体与所设计免疫毒素之间氢键和疏水键数量最多,选择最佳复合物。此外,加权评分和结合亲和力(ΔG)分别为-1025.9和-20.8 (Kcal/mol)。结果表明设计的免疫毒素与HER2受体之间存在较强的相互作用 (图6)。
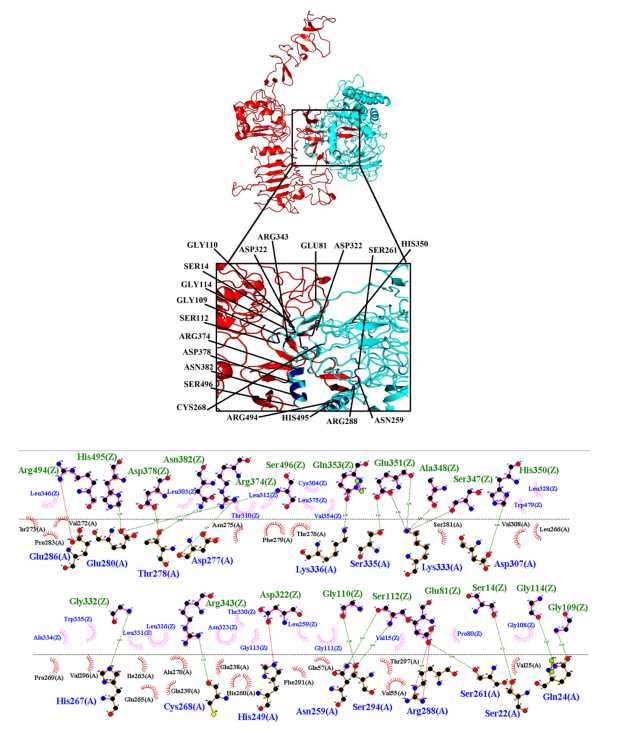
图6:HER2-免疫毒素复合物的分子对接为红色,设计的免疫毒素为蓝色。在特写图中,显示了与设计的免疫毒素相互作用的HER2结合位点中的残基。b HER2和设计的免疫毒素之间疏水和氢相互作用的LIGPLOT表示。HER2(绿色)和免疫毒素(绿色)残基之间的氢键用蓝色虚线表示,疏水作用用代表HER2残基(黑色)和免疫毒素残基(蓝色)的轮辐弧表示。
8
分子动力学研究
计算机模拟为理解粘附的基本物理和力学提供了一种强大的技术。蛋白质-蛋白质相互作用在大多数细胞过程和生物学功能中起着关键作用。MD模拟是一种简单而快速的评估蛋白-蛋白相互作用和复合物稳定性的方法。
通过MD模拟实验评价HER2 -免疫毒素复合物的稳定性。通过基于骨架结构的RMSD评估100 ns过程中的结构变化。结果表明,在100 ns模拟过程中,HER2 -免疫毒素复合物的RMSD值稳定(图7)。HER2 -免疫毒素复合物的平均RMSD值为1.2 nm。该复合物骨架原子的RMSD表明,经过约40 ns的模拟后,复合物达到稳定状态,并一直保持到100 ns。通过Rg值评估蛋白-蛋白复合物的折叠和致密性,HER2-免疫毒素复合物的Rg值范围为3.4 ~ 3.8 nm,模拟50 ~ 100 ns时间的Rg值范围为3.7 ~ 3.8。这些结果表明,在100 ns模拟过程中,HER2-免疫毒素复合物中蛋白质的压缩发生了最小的变化(图8)。RMSF值反映了蛋白质在模拟时间内的灵活性和结构变化。设计的免疫毒素和HER2蛋白的RMSF图表明,随着模拟时间的推移,每个残基的灵活性和互动性最小。对这一结果的分析表明,免疫毒素与HER2受体对接后是稳定的。
蛋白质复合物中的氢键在其稳定性中起重要作用。如图5所示,在MD模拟过程中,氢键数量是稳定的。SASA值评估分子与溶剂的结合水平,对HER2-免疫毒素复合物的SASA图分析显示,在MD模拟过程中,分子与溶剂的结合表面积稳定。
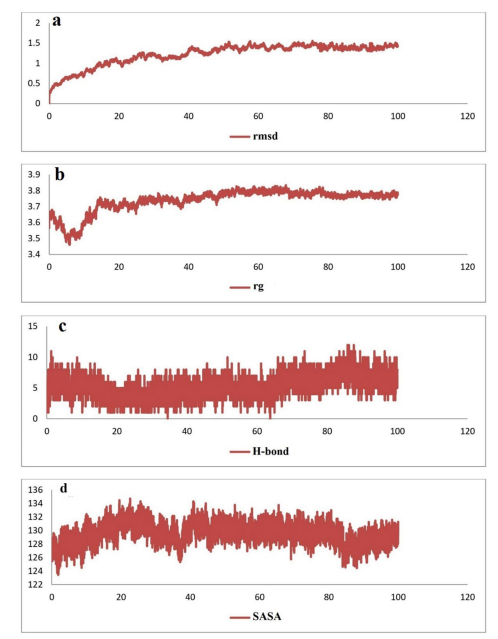
图7:MD模拟分析HER2 -免疫毒素复合物在100 ns时期的变化。a RMSD图,b Rg图,c H-bonds图,d SASA图
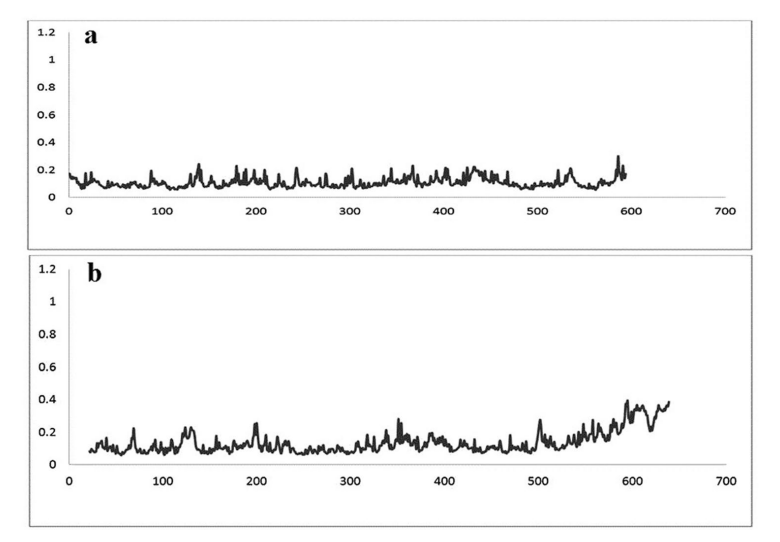
图8:MD模拟分析100 ns时期HER2-免疫毒素复合物,a为设计免疫毒素的RMSF图,b为HER2受体的RMSF图
结论:
在本研究中,作者通过计算机模拟设计一种有效的抗HER2阳性乳腺癌的免疫毒素,该毒素对赫赛汀耐药。采用不同的生物信息学工具和服务器对免疫毒素的构象和结构进行评价。此外,通过对接和MD研究分析其与HER2受体的结合亲和力。结果表明,所设计的免疫毒素构象正确,结构稳定。结合实验结果表明,该免疫毒素能与HER2受体有效结合。