
在制药行业向高质量发展迈进的过程中,BE(生物等效性)试验正经历一场深刻的数字化变革。2025年末《生物等效性试验电子化记录技术指南(试行)》的发布,标志着行业正式跨越了“是否需要电子化”的疑虑,进入了“如何高标准实现全链路数字化”的实战阶段。本文旨在解析合规新常态下的技术路径,并探讨如何通过全闭环解决方案实现实验室的数字化重塑。
一、监管趋势
从“辅助工具”到“核心底座”
BE生物等效性试验电子化
随着CFDI政策信号的释放,电子记录不再是纸质文档的附属品,而是评价研究真实性与合规性的主要载体。指南释放的核心信息十分明确:

不可逆转性: 鼓励全过程电子化,减少纸电并行的冗余风险。
差异化管理: 针对不同业务领域(临床与实验室)匹配差异化的系统架构,确立了“场景决定系统”的原则。
二、架构逻辑
划清ELN与EDC的职能边界
BE生物等效性试验电子化
指南明确了实验室与临床现场的数字化分工,这为企业的系统采购与架构设计提供了准绳:
实验室端(样品检测/药学研究): 核心聚焦于ELN(电子实验记录本)与LES(实验室执行系统)。其目标是确保实验过程、试验资源、试验样品流转及原始数据的真实准确、数据完整可靠、数据可追溯。
临床端(受试者管理): 依然由EDC(电子数据采集系统)主导。
启示: ELN已成为BE实验室不可或缺的“数字化基础设施”,而非可有可无的插件。
三、监管外延
非BE研究的“合规连锁反应”
BE生物等效性试验电子化
尽管指南冠名“BE”,但其背后的风险评估逻辑具有普适性。药学研究、分析方法验证、稳定性研究等关键领域,正参照该指南的原则,加速向数字化对标。这意味着,一套成熟的数字化方案必须具备高度的可扩展性,以兼容未来的全药研生命周期管理。
四、落地挑战
数字化转型的“深水区”
BE生物等效性试验电子化
简单的“纸质文档电子化”并不能满足监管要求。企业在实际推行中面临五大痛点:
1. 项目维度的溯源难题:如何在海量数据中实现按项目、按批次的快速调取与复核?
2. 动态审计追踪:如何确保留痕不仅存在,而且具备逻辑一致性(Who, When, Why, How)?
3. SOP的硬约束:如何通过系统实现过程强制校验,避免人为“事后补录”?
4. 资源联动闭环:物料、仪器、样品与实验记录如何形成互证的证据链?
5. 验证成本与周期:复杂的系统验证如何不在项目上线前成为绊脚石?
五、创腾一体化方案
构建“合规+数据”双引擎
BE生物等效性试验电子化
创腾科技以 iLabPower(数字化研发平台) 为核心,结合 SDH(科学数据中心) 与 验证云,构建了从数据产生到决策分析的闭环生态。
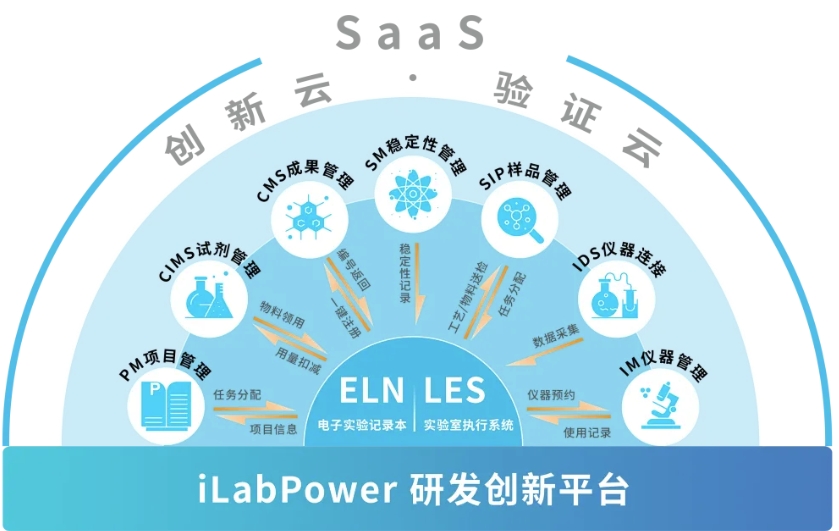
iLabPower:实验室运行的数字大脑
以ELN为枢纽,实现实验室要素的全要素数字化:
精准记录:模板化录入与参数校验,消除合规“黑洞”。
全链路追溯:深度整合项目管理(PM)、试剂物料(CIMS)、仪器管理(IM)与生物样品(BIMS),让每一笔记录都有迹可循。
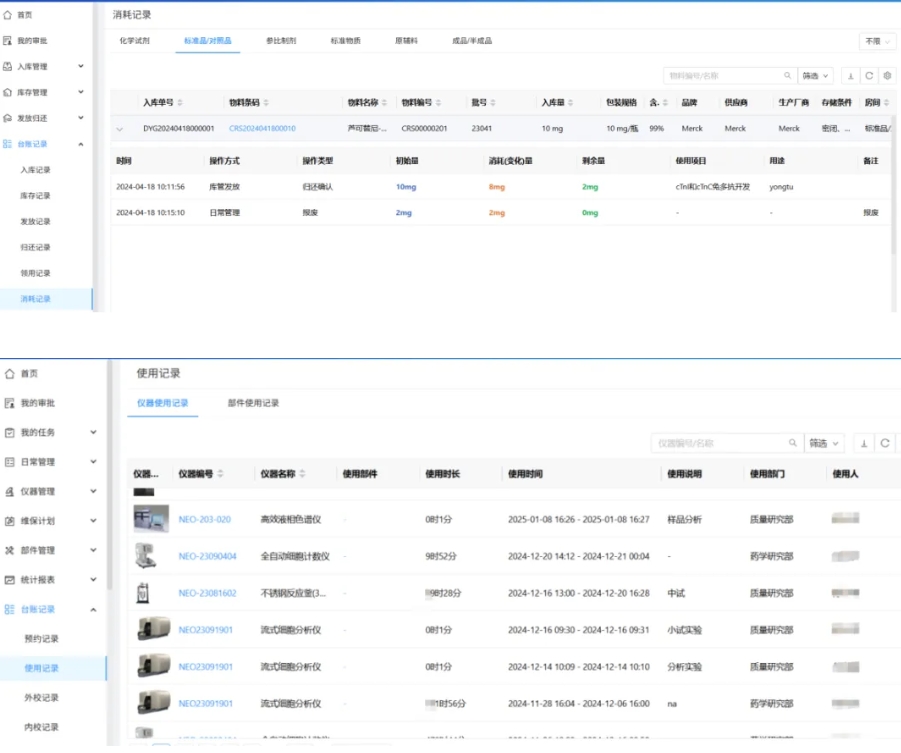
多人协作: 同一试验多人同时协作,处理不同试验工作,同时记录权限记录数据,共同输出一份报告,高效协作。
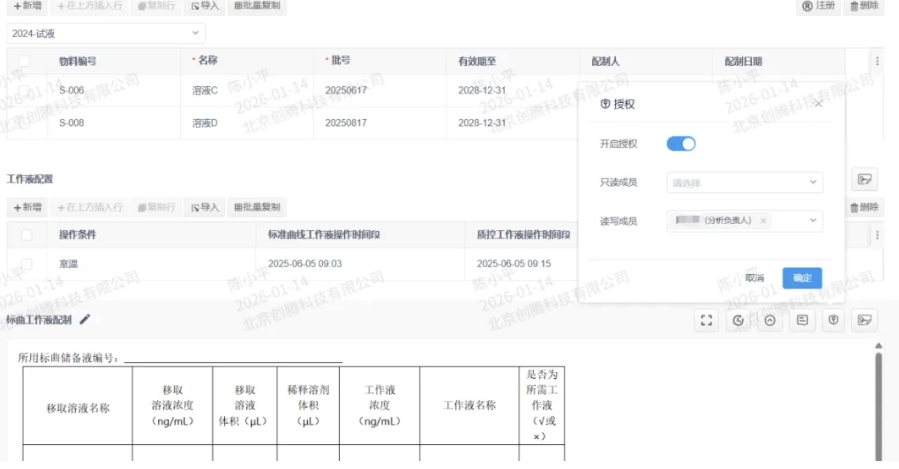
LES(SOP Driven 的ELN):过程受控的硬核保障
针对高重复性、高合规风险的操作,LES通过数字化SOP引导,实现“手把手”的过程控制,确保操作合规性与数据采集的实时化。
验证云:合规交付的“加速器”
创腾独具特色的“预验证+快速PQ”模式,利用供应商已完成的DQ/IQ/OQ成果,帮助用户聚焦业务层面的PQ验证。这不仅缩短了50%以上的上线周期,更通过持续的变更管理,确保系统长期的验证状态。
SDH:释放数据的资产价值
SDH不仅是存储器,更是数据过滤器。它能将离散在各系统中的BE原始记录,转化为可复核、可审计、可视化的报表。
审计支持:一键生成面向QA或官方检查的追溯视图。
决策辅助:通过BI仪表盘监控实验趋势与异常波动。
六、差异化价值
为什么是“一体化”而非“碎片化”?
BE生物等效性试验电子化
在BE领域,单点式的系统堆砌往往导致数据断层。创腾的优势在于“全域集成”:
证据链条化:将实验要素串联在同一个项目序列中。
节点强制化:关键节点必须电子签名,审计追踪实时触发。
场景贴合化:针对BE特有的生物样本管理、分析方法转移等场景有深度沉淀。
七、从“被动响应”转向
“主动赋能”的数字化升级
BE生物等效性试验电子化
BE试验的数字化进程,本质上是企业质量文化的一场自我迭代。告别纸笔,不仅是为了满足监管指南的要求,更是为了通过技术的确定性,去消除人为操作的不确定性。创腾科技提供的不仅是工具,而是一条经过验证的、兼顾合规深度与运行广度的数字化转型捷径。在未来的药研竞争中,拥有高质量数据资产的企业,必将走在行业的最前沿。















